不凍タンパク質とは
不凍タンパク質とは
不凍タンパク質(Antifreeze protein:AFP、不凍糖タンパク質AFGPを含む)は、低温環境下に生息する魚や昆虫、植物、微生物などから見つかっているタンパク質で、生体において、凝固点(凍る時の温度)を低下させ、凍結防止や氷結晶の再結晶化防止による生物の生命維持に寄与するタンパク質です。
不凍タンパク質は、凍結の瞬間に水の内部に無数に生成する微小な氷結晶の表面に強く結合し、その成長を抑えます。通常、水溶液中で生成した氷結晶は円盤?楕円状に大きくなっていきますが、不凍タンパク質が氷にくっつくことで、氷結晶の形状が変わり、多少温度を低下させたとしても、氷結晶の大きさがほとんど変化しなくなります。また、魚が有する不凍タンパク質には、細胞の寿命を延ばす効果が見られ、脂質二重膜に不凍タンパク質が付着していることがわかっています。

弊社はこれまで国立研究開発法人 産業技術総合研究所と共に魚類不凍タンパク質を効率的に取得する技術の開発を進めてきました。
魚類不凍タンパク質にはアミノ酸組成と立体構造が異なる複数の種類があり、それぞれ氷結晶や細胞に及ぼす性質が異なります。
魚類不凍タンパク質の種類
| 保有する魚の種類 | アミノ酸配列の特徴 | 3次元構造 | |
|---|---|---|---|
| 不凍糖タンパク質(AFGP) Mw = 2,600-33,000 |
Emerald Rockcod 
ノトセニア科、タラ科 |
2糖で修飾された アラニン-アラニン-スレオニンの繰り返し |
未決定 ポリプロリンⅡヘリックス構造が予測されている |
| Ⅰ型AFP Mw = 3,300-4,500 |
Winter Flounder 
カレイ科、カジカ科 |
Thr-X10 (Xは主にAla)の繰り返し単位で構成される |
 αヘリックス構造と呼ぶ |
| Ⅱ型AFP Mw = 14,000-24,000 |
Atlantic Herring 
ニシン科、キュウリウオ科、ケムシカジカ科 |
Ca2+依存型レクチンの糖鎖認識ドメインとの相同性が高い |
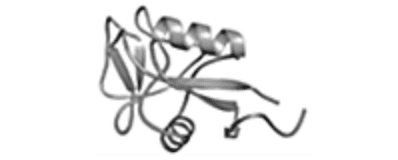 S-S結合で安定化されている |
| Ⅲ型AFP Mw = 6,500-7,000 |
Ocean Pout 
ゲンゲ科 |
様々なアミノ酸で構成されるS-S結合を含まないものが多い |
 βサンドイッチ構造を含む |
参考文献・リンク
【参考文献】生物物理43(3),130-135(2003)
Kamijima et.al, PLoS One. 2013 Sep 17;8(9):e73643
「不凍タンパク質の機能と応用」シーエムシー出版 第3篇 実用化 第25章 魚類不凍タンパク質製品の性質と食品への応用
【リンク先】津田栄 Tsuda Sakaeホームページ-東京大学
連結して氷の結晶成長を食い止める不凍タンパク質を発見
http://www.aist.go.jp/aist_j/new_research/2017/nr20170216/nr20170216.html
