氷の実験室 食塩水と砂糖水の凍り方
凝固点降下の実験(2)
もともとニチレイは氷屋さんでした。
氷が大好きなニチレイはこの「氷の実験室」で、みなさんと一緒に「氷」の秘密をじっと見つめ考えていきたいと思います。
雪と氷が大好きなレイちゃんとロジロジくん、氷博士の石井先生と一緒に、氷の不思議に触れてみましょう。
もっと知りたい!
食塩水と砂糖水の凍り方比べ
用意するもの
- 水100gに食塩10gを溶かした食塩水(A)
- 水100gに砂糖10gを溶かした砂糖水(B)
- 試験管など同じ形の透明容器2つ
- 氷、塩
- 氷を入れるボウルなどの容器
- 温度計

手順
- 1. 試験管などの透明容器2つに、(A)と(B)を同量ずつ入れます。
- 2. 氷をボウルに7分目くらいの高さまで入れ、氷の重さの1/3くらいの量の塩を振りかけて混ぜます。ボウルの中に温度計を入れ、温度を測ります。
- 3. 2のボウルの中はどんどん温度が下がっていきます。(A)、(B)の入った透明容器をその中に入れて、冷やします。
- 4. (A)、(B)の入った透明容器の中をかき混ぜながら温度を測り、凍り始めときの温度や凍り方を観察しましょう。
予想
食塩水Aと砂糖水Bでは凍る温度は変わるでしょうか?
-
A
A・Bどちらも同じ温度で凍る
-
B
AがBよりも高い温度で凍る
-
C
AがBよりも低い温度で凍る
- 答え
-
C 食塩水(A)が砂糖水(B)よりも低い温度で凍る
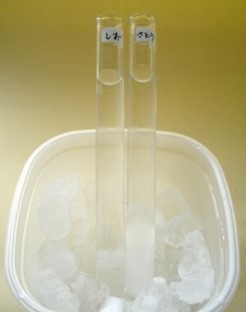
同じ濃度の水溶液でも、溶けているものによって、凍る温度は変わります。同じ濃度の食塩水と砂糖水では、食塩水の方がかなり低い温度にならないと凍りません。この実験の場合は、砂糖水は約-0.7℃で凍ったのに対して、食塩水は約-5.6℃で凍りました。

教えて!氷博士
- 水にいろいろなものが溶けていると、どうして凍る温度が低くなるの?
-
水に溶けている物質の粒で、水分子どうしが結びつきにくくなるのです。
水に砂糖などの不揮発性の物質を溶かすと、水溶液が凍る温度(凝固点)は0℃よりも低くなります。この現象を凝固点降下といいます。水が凍るときは水分子同士が結びついて氷になります。ところが、水溶液の場合、水に溶けている物質の粒がじゃまをして、水分子同士が結びつきにくい状態になっています。このため、水溶液を凍らせるには0℃よりも温度を低くする必要があるのです。水に溶けている物質の粒の数が多いほど、水溶液の凝固点は低くなります。
さらに、実験5-2では食塩水と砂糖水は同じ濃さなのに、食塩水の方がより低い温度で凍りました。これは、食塩と砂糖の粒のつくりの違いが関係しています。食塩と砂糖が水に溶けたときの粒の様子は、図のように考えることができます。同じ質量の水に、食塩と砂糖をそれぞれ同じ質量だけ溶かすと、砂糖水よりも食塩水の方が、水に溶けている物質の粒の数が多くなります。このため、食塩水の方が、より低い温度で凍ったのです。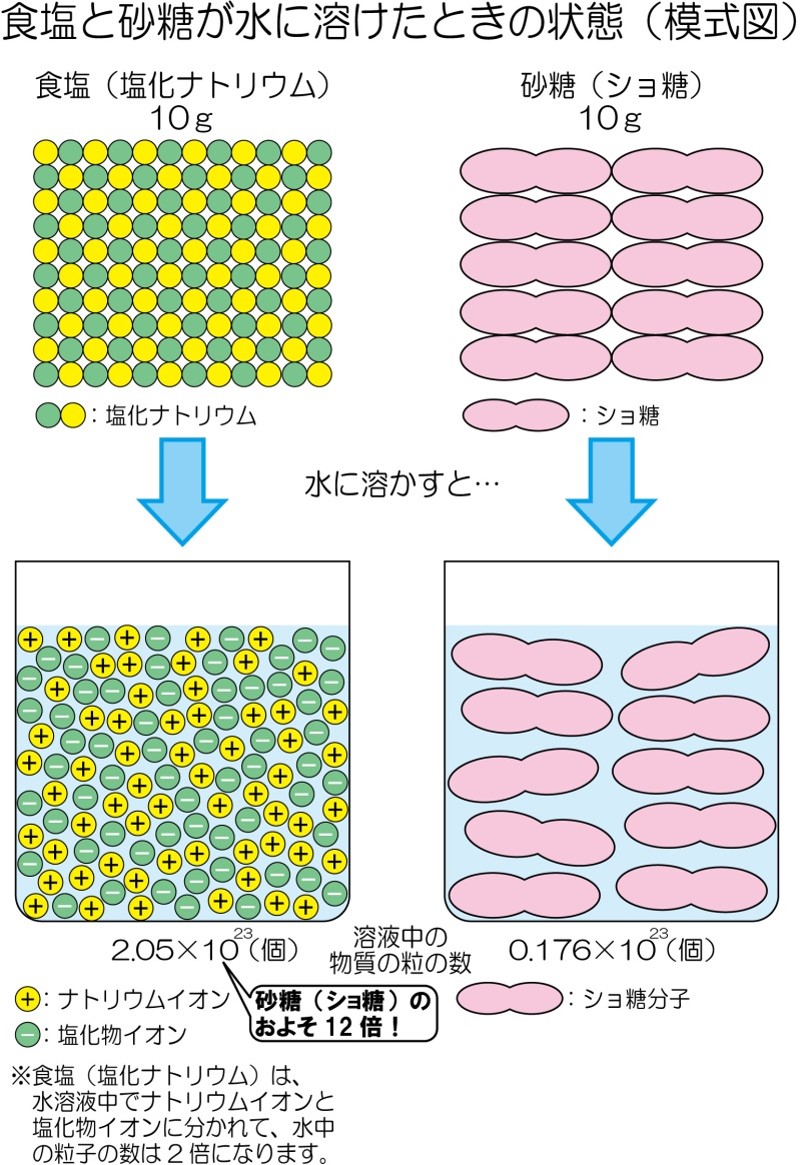

この「氷の実験室」は、自由研究など幅広く活用していただきたいと思って作りました。
非営利目的での複製・転載などについてのご要望は、以下からお問い合わせ下さい。
2022年1月24日